Product Articles
Life Science
การประยุกต์ใช้ Digital PCR เพื่อการวิเคราะห์การแสดงออกของยีน
การประยุกต์ใช้ Digital PCR เพื่อการวิเคราะห์การแสดงออกของยีน
การแสดงออกของยีนเป็นกระบวนการที่ครอบคลุมตั้งแต่การสร้างและส่งออก mRNA ไปจนถึงการถอดรหัสโปรตีน (Translation) และการดัดแปลงหลังการแปล ซึ่งแต่ละขั้นตอนถูกควบคุมอย่างเข้มงวด ปัจจุบันมีเทคนิคทางอณูชีววิทยาหลายชนิด เช่น Microarray, Northern blot และ PCR ที่ใช้ในการหาปริมาณ mRNA เนื่องจากให้ผลรวดเร็ว แม่นยำและยอมรับได้
Digital PCR (dPCR) เป็นเทคโนโลยีใหม่ที่อยู่ในกลุ่มเทคนิค PCR ซึ่งช่วยเพิ่มความแม่นยำในการวิเคราะห์การแสดงออกของยีน โดยใช้หลักการแบ่งปฏิกิริยาออกเป็นหลายพันถึงหลายหมื่นปฏิกิริยาย่อยๆ และตรวจสัญญาณแบบสิ้นสุดปฏิกิริยา (End-point detection) ทำให้สามารถหาปริมาณโมเลกุลเป้าหมายได้โดยตรงด้วยสถิติปัวซอง (Poisson statistics) และรายงานผลเป็นจำนวน Copy ต่อไมโครลิตร (copy number per microliter) โดยไม่ต้องพึ่งกราฟมาตรฐาน (Standard curve)
QuantStudioTM Absolute Q dPCR

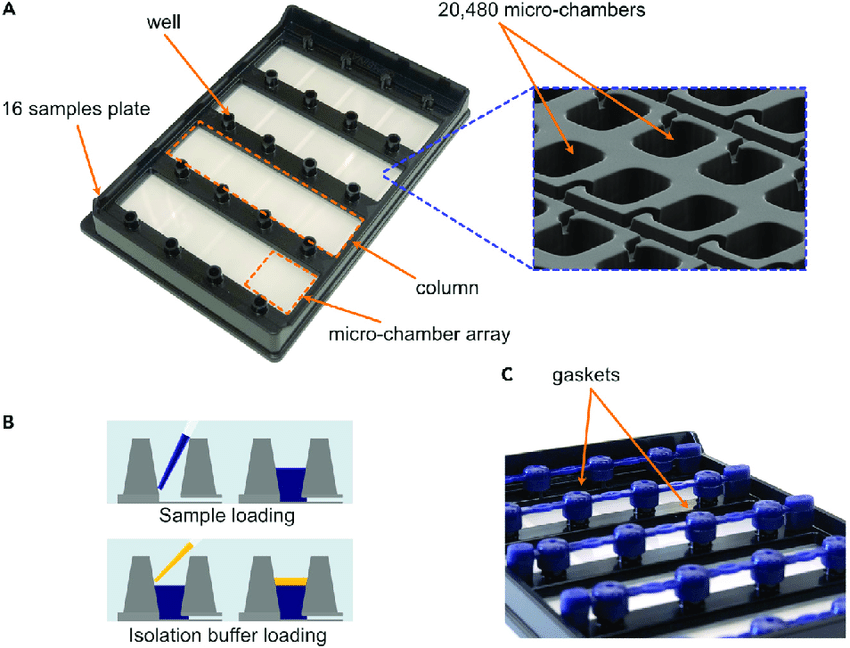
ภาพที่ 1 เครื่อง QuantStudioTM Absolute Q dPCR ซึ่งใช้กับ (A) 16 Micro Array Plate (16MAP) มีจำนวน 20,480 microchamber เพื่อแบ่งปฏิกิริยา PCR ย่อย โดย (B) วิธีหยอดตัวอย่างลงในหลุมจะต้องหยอด Isolation buffer เพื่อช่วยในการกระจายตัวอย่างลงสู่ microchamber และ (C) Gaskets ยางสำหรับปิดหลุมหยอดตัวอย่าง
ปัจจุบัน เครื่อง dPCR ของ Applied Biosystems ได้พัฒนาให้รองรับการใช้งานร่วมกับ 16MAP Plate ซึ่งมีการแบ่งปฏิกิริยาออกเป็นปฏิกิริยาย่อย จำนวน 20,480 microchambers ช่วยป้องกันการไหลปะปนกันของแต่ละปฏิกิริยาย่อยและทำให้ขั้นตอนเตรียมตัวอย่างง่ายขึ้น
ในการเตรียมตัวอย่าง ผู้ใช้เพียงผสมน้ำยา Master mix ที่ความเข้มข้น 1× และหยอดลงในหลุม จากนั้นเติม Isolation Buffer เพื่อช่วยลดการระเหยของตัวอย่างและช่วยให้สารผสมกระจายลงสู่ไมโครแชมเบอร์ทั้งหมดได้อย่างทั่วถึง ก่อนนำ Gasket ที่มาพร้อมเพลทมาปิดหลุมตัวอย่าง บริเวณยาง Gasket จะมีช่องสำหรับให้ระบบปั๊มของเครื่องอัดอากาศเข้าไปเพื่อกระจายตัวอย่างให้เต็มพื้นที่ของเพลท (ภาพที่ 1)
หลังจากทำปฏิกิริยา ระบบจะนับจำนวนไมโครแชมเบอร์ที่ตรวจพบสัญญาณฟลูออเรสเซนต์ ซึ่งจะแสดงถึงการเพิ่มจำนวนของสารพันธุกรรมในแต่ละช่องปฏิกิริยาย่อย จากนั้นจึงคำนวณด้วย Poisson statistics เพื่อให้ได้ค่าปริมาณสารพันธุกรรมในรูป copy number per microliter (ภาพที่ 2)
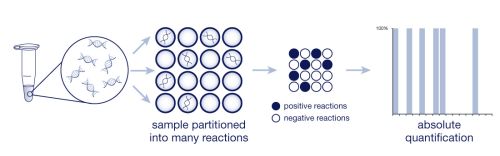
ภาพที่ 2 PCR ดิจิทัลใช้อัตราส่วนของปฏิกิริยา PCR เชิงบวก (สีดำ) ต่อปฏิกิริยา PCR เชิงลบ (สีขาว) เพื่อนับจำนวนโมเลกุลเป้าหมาย
ที่มา: https://www.gene-quantification.de/digital.html
การศึกษาการแสดงออกของยีน
การแสดงออกของยีน (Gene expression) คือกระบวนการที่ข้อมูลใน DNA ถูกถ่ายทอดเป็น RNA และโปรตีน กระบวนการนี้ประกอบด้วยขั้นตอนสำคัญ ได้แก่ การถอดรหัส (Transcription) ที่สร้าง mRNA จาก DNA และการแปลรหัส (Translation) ที่สร้างโปรตีนจาก mRNA ซึ่งมีบทบาทสำคัญต่อการทำงานและความสมดุลของเซลล์
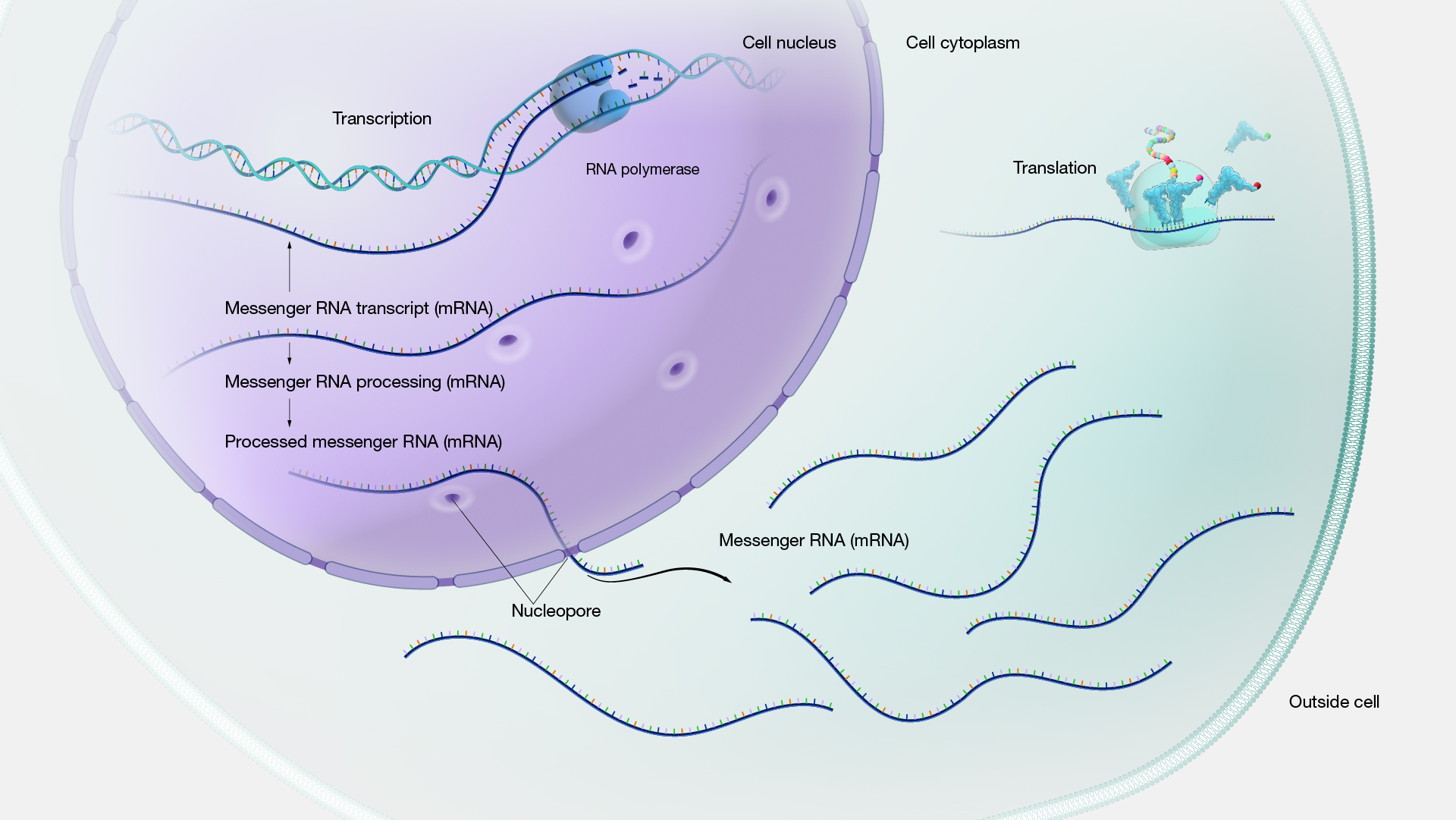
ภาพที่ 3 กระบวนการแสดงออกของยีน การถ่ายทอดสารพันธุกรรมและการถอดรหัสพันธุกรรมภายในเซลล์
ที่มา: https://www.genome.gov/genetics-glossary/Gene-Expression
การศึกษาการแสดงออกของยีนช่วยให้เข้าใจการเปลี่ยนแปลงทางชีวภาพเมื่อเซลล์เผชิญสภาวะที่ต่างกัน รวมถึงกลไกการเกิดโรค ความรุนแรง และการดื้อยาของเชื้อโรค เทคนิคที่ใช้ทั่วไป เช่น qPCR, RT-qPCR, NGS, RNA-seq และ microarray แม้จะมีประสิทธิภาพ แต่ยังมีข้อจำกัดด้านความไว (Sensitivity) และยังคงต้องสร้างกราฟเพื่อเทียบเป็นค่าอ้างอิงมาตรฐาน (Standard curve)
ปัจจุบัน Digital PCR (dPCR) ถูกพัฒนาขึ้นเพื่อนำมาใช้เพิ่มความแม่นยำในการวัดระดับยีน โดยแบ่งสารพันธุกรรมเป็นปฏิกิริยาย่อยจำนวนมาก ทำให้ตรวจจับโมเลกุลเดี่ยวได้และให้ผลแบบ absolute quantification ที่ไม่ต้องสร้างกราฟมาตรฐาน จึงเหมาะกับยีนที่แสดงออกต่ำหรือยีนเป้าหมายที่พบเจอได้ยาก (Rare target) ในงานเชิงโมเลกุล เช่น ยีนดื้อยาและยีนก่อโรค รวมความสามารถทนต่อสารยับยั้ง PCR การใช้ dPCR จึงช่วยให้วิเคราะห์การแสดงออกของยีนได้อย่างแม่นยำ เชื่อถือได้ และตอบโจทย์งานวิจัยที่ต้องการความไวสูง
คำถามที่พบบ่อย
1) dPCR เปรียบเทียบกับวิธีอื่นๆ ในการวิเคราะห์การแสดงออกของยีน เช่น qPCR, NGS หรือ microarray อย่างไร?
ตอบ หลักการของ dPCR คำนวณจากจำนวนปฏิกิริยาย่อยที่เกิดขึ้นบนเพลทและใช้สูตรทางสถิติ ที่สามารถได้ผลเป็นปริมาณ mRNA เป้าหมายได้ โดยไม่ต้องใช้กราฟมาตรฐาน การให้ผลที่มีความแม่นยำ และความไวสูงของ dPCR ช่วยให้สามารถหา mRNA เป้าหมายที่มีปริมาณน้อยได้อย่างน่าเชื่อถือ และตรวจจับการเปลี่ยนแปลงเพียงเล็กน้อยของปริมาณ mRNA เป้าหมายได้
2) ข้อดีของการใช้ dPCR สำหรับการวิเคราะห์การแสดงออกของยีนคืออะไร?
ตอบ dPCR ช่วยเพิ่มความแม่นยำในการตรวจระดับการแสดงออกของยีน โดยเฉพาะในกรณีที่ยีนมีปริมาณน้อยหรือมีการเปลี่ยนแปลงเพียงเล็กน้อย ซึ่งอาจตรวจยากด้วย qPCR นอกจากนี้ยังเหมาะสำหรับใช้ยืนยันผลจาก qPCR และสามารถวิเคราะห์หลายยีนพร้อมกันได้ในปฏิกิริยาเดียวแบบ Multiplex PCR
3) ข้อดีของการใช้ dPCR กับตัวอย่างที่มีจำนวนจำกัดหรือตัวอย่างที่มีความท้าทายคืออะไร?
ตอบ ตัวอย่างชีวภาพหรือสิ่งแวดล้อมมักมีสารยับยั้ง PCR ที่กำจัดได้ยาก ซึ่งอาจทำให้ qPCR ตรวจพบยีนเป้าหมายได้น้อยลง แต่ใน dPCR ปฏิกิริยาจะถูกแบ่งออกเป็นปฏิกิริยาย่อยจำนวนมาก ทำให้สารยับยั้งถูกเจือจางลง และเพิ่มโอกาสในการพบยีนเป้าหมาย dPCR จึงมีความทนทานต่อสารยับยั้งสูงกว่า และสามารถวัดปริมาณยีนได้แม่นยำกว่าวิธีอื่น โดยเฉพาะในตัวอย่างที่ปริมาณน้อยหรือมีความยากในการเตรียมตัวอย่าง
ศึกษาข้อมูลเพิ่มเติม:
หรือติดต่อแผนก Technical Support e-mail: TAS@3nholding.com
หรือฝ่ายงาน Life Science Product โทร 02-274-8331
ศึกษาข้อมูลเพิ่มเติม https://www.thermofisher.com/th/en/home/life-science/pcr/digital-pcr/education/basic-research/gene-expression-analysis.html#:~:text=our%20technical%20note.-,Frequently%20asked%20questions,provides%20greater%20flexibility%20for%20multiplexing
บทความโดย รวมพร สืบสกุลไพศาล
Technical Application Specialist














